近日,我校交叉科学研究院葛广波教授团队在Acta Pharmaceutica Sinica B杂志在线发表了题为Discovery of a novel AhR-CYP1A1 axis activator for mitigating inflammatory diseases using an in-situ functional imaging assay的研究论文。该研究借助自主研发的原位功能成像分析方法发现了一种新型AhR-CYP1A1轴激活剂并将其用于炎症性疾病的治疗。

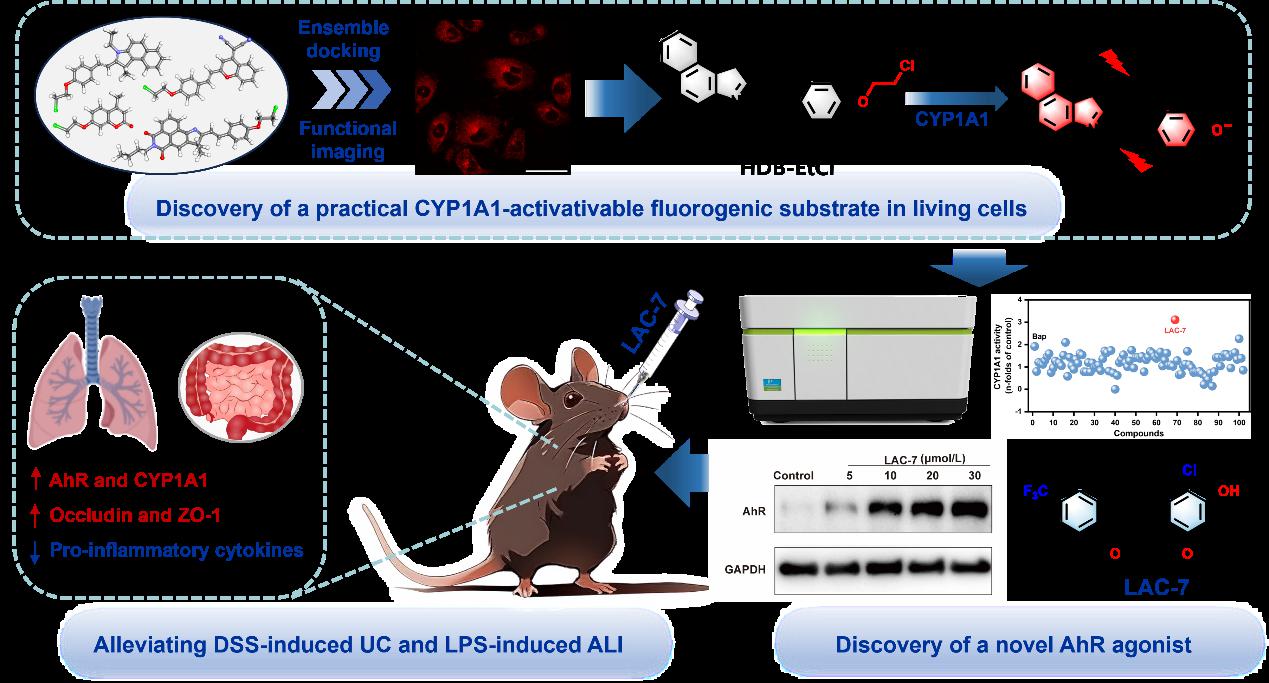
芳烃受体(AhR)是一种典型的配体激活转录因子,在多种生理过程(如异物质代谢、细胞发育和分化、干细胞维持等)的调节中发挥着至关重要的作用。越来越多的研究表明,AhR与炎症、代谢紊乱、癌症、自身免疫性疾病的发生发展关系密切,在特定细胞环境中激活AhR已成为治疗炎症性疾病的有效策略。虽然AhR萤光素酶报告基因法常被用于快速筛选AhR的激活剂,但该方法仅能反映AhR与受试配体结合后转录活性的变化。由于在生命体系中,AhR、CYP1As与小分子配体间的相互作用十分复杂,AhR下游基因产物CYP1As和AhRR等蛋白可通过多种机制负反馈调节该信号通路。因此,业界急需构建可在活细胞等复杂生命体系真实反映AhR信号通路激活程度的实用方法。考虑到CYP1A1是AhR激活的重要表型标志物及下游标志性基因产物,同时CYP1A1也是调控脂肪酸代谢和炎症性疾病的关键蛋白,在活细胞等复杂生命体系中原位可视化监测CYP1A1功能的动态变化有望为AhR激动效应的精准评估提供实用且可靠的方法。然而,已报道的CYP1A1荧光底物普遍存在特异性差、灵敏度有限、细胞膜通透性差等问题,且多数CYP1A1底物的酚类产物易被II相代谢酶(如尿苷二磷酸葡萄糖醛酸转移酶和磺酸基转移酶)代谢,难以实现长时程成像分析。这些局限极大地限制了研究者借助CYP1A1荧光底物开展复杂生命系统中CYP1A1的原位可视化分析和药物筛选等应用。
针对上述科学问题,我校葛广波教授团队结合分子理性设计和基于活细胞的荧光底物筛选策略,构建了一种高效、实用的CYP1A1功能原位成像分析新方法,并将其用于AhR-CYP1A1轴调控剂的高效发现和精准评价。作者首先通过系综对接和细胞功能成像分析,发现了一种亚型特异性高、细胞膜通透性好且可用于活细胞长时程成像分析的CYP1A1荧光底物(HDB-EtCl)。该荧光底物可用于多种活细胞及组织切片中CYP1A1的功能成像分析。研究团队借助该荧光底物构建了适于活细胞的CYP1A1功能原位成像分析新方法,并将其与AhR萤光素酶报告基因法联合用于高效发现AhR-CYP1A1轴的调控剂。通过对自建化合物库的规模化筛选,团队发现了一种新型的AhR-CYP1A1轴强效激活剂LAC-7。LAC-7可在多种细胞系中显著上调CYP1A1和AhR的表达水平,还可通过抑制巨噬细胞M1极化,降低LPS诱导的骨髓来源巨噬细胞(BMDMs)中炎症因子的水平。安全性研究发现连续14天口服高剂量LAC-7没有导致小鼠死亡,且未观察到血液毒性、器官损伤或明显异常。组织分布显示LAC-7在小鼠肠道中高暴露,其次在肺组织中也有较高暴露。体内试验表明,LAC-7能显著缓解DSS诱导的小鼠溃疡性结肠炎和LPS诱导的小鼠急性肺损伤,明显降低多种炎症因子的水平,显著增加模型组小鼠肠和肺组织中紧密连接蛋白的表达水平,恢复屏障系统的完整性。综上所述,该研究通过开发基于活细胞的药物筛选新方法,实现了复杂生物体系中CYP1A1酶活的原位功能成像分析,极大地促进了AhR-CYP1A1轴调节剂(新型抗炎候选药物)的高效发现和精准评价。
我校交叉科学研究院博士后张凤和科研助理赵蓓为论文共同第一作者,葛广波教授为论文的唯一通讯作者,上海中医药大学为本论文的唯一通讯单位。该研究工作得到国家重点研发计划和国家自然科学基金等项目的支持。(科技处、交叉科学研究院)


