近日,我校交叉科学研究院柯细松团队提出了类泛素化依赖的蛋白酶体降解途径(UBLPD)及其在疾病发生发展中的作用,为全面理解蛋白酶体系统和开发蛋白降解相关药物提供了一个全新视角。相关论文以Ubiquitin-like modification dependent proteasomal degradation and disease therapy为题发表于Cell Press综述系列期刊Trends in Molecular Medicine。
蛋白酶体是细胞中蛋白降解的主要机器。一般认为蛋白降解需要泛素化修饰,即所谓的泛素-蛋白酶体系统(Ubiquitin proteasome system, UPS),但越来越多蛋白的蛋白酶体降解被发现并不依赖泛素的修饰。作者的前期研究表明,经典的UPS底物β-catenin的蛋白降解并不依赖于Ub修饰,而是依赖类泛素(Ubiquitin-like, UBL)蛋白NEDD8的修饰(Wang B, et al, Cell Reports 2022)。基于此,作者系统地探讨了多种UBL依赖的蛋白酶体降解途径(UBL-dependent proteasome degradation, UBLPD),并提出细胞内存在独立于UPS的蛋白酶体降解系统,即类泛素化蛋白酶体系统(UBL-proteasome system, UBLPS)。

在本文中,作者提出UBLPS包括三个层次:多种UBL蛋白、相应的蛋白酶体调节亚基和共同的20S核心亚基。目前已知的类泛素蛋白有8种,包括NEDD8、FAT10、SUMO1、ISG15、URM1、UFM1、ATG8和ATG12等,其中前5种UBL介导蛋白酶体降解的功能已经被证实。与Ub不同,一些UBL蛋白(如NEDD8和FAT10)在降解过程中通常不被回收利用,而是与底物一起被降解。蛋白酶体调节亚基包括19S/PA700、PA28αβ、PA28γ和PA200等。其中19S/PA700和PA28γ已经被证实介导UBLPD,PA28αβ和PA200的功能还有待验证。
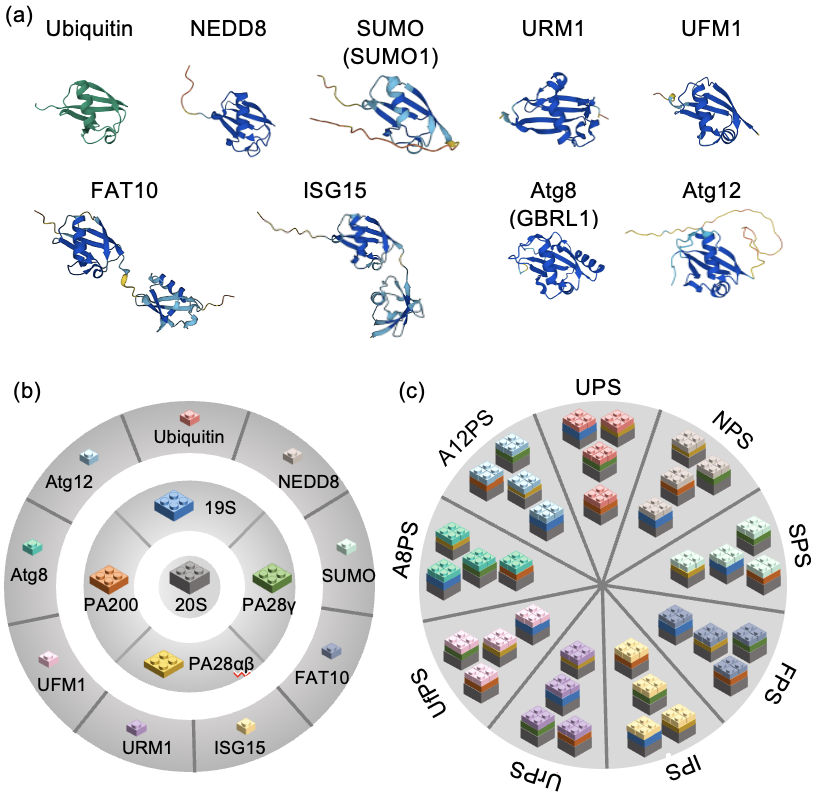
UBLPD对疾病治疗和药物开发具有什么意义?在神经退行性疾病和肌肉萎缩疾病中往往伴随着蛋白酶体降解功能的不足或过度激活,其中UBL蛋白、E3连接酶及其修饰底物在这些疾病中有显著的改变。因此,针对UBLPD的抑制剂,如MLN4924和TAK-981,可能有助于阻断这些疾病中的蛋白降解过程。此外,鉴定UBLPD开发新促蛋白降解药物比如PROTACs非常重要。很难想象,如果介导蛋白降解的修饰是UBL,基于Ub修饰而设计的PROTAC弹头如何能实现靶向降解作用。最后,作者认为,随着选择性Ub抑制剂(TAK-243)的广泛应用,相信越来越多的蛋白被鉴定为UBLPD底物。深入研究UBLPD不仅有助于理解蛋白酶体系统的全景图,而且有望为开发蛋白降解相关治疗药物提供新机会。
上海中医药大学为该论文唯一署名单位,我校2023级博士研究生王甜甜、2022级硕士研究生姜婕和副研究员张雪为论文共同第一作者,中药化学生物学研究中心研究员柯细松和屈祎为共同通讯作者。该研究得到国家自然科学基金、上海市优秀学术带头人、上海市科研创新计划重大项目和上海中医药大学有组织科研重点专项的资助和支持。(科技处)


